第一類醫療器械生產企業備案管理辦法
2024-03-08
第一類醫療器械生產企業備案管理辦法
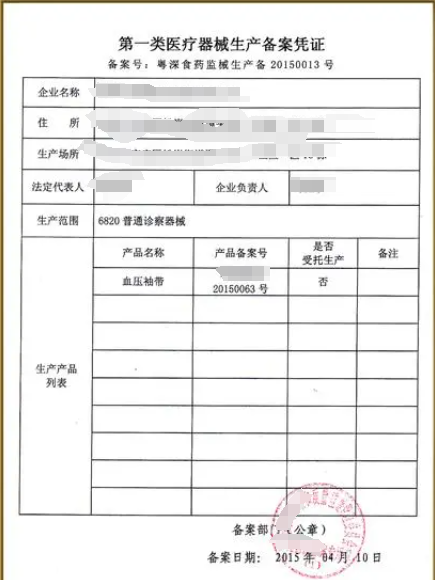
以下是-錢生錢財務咨詢-海南企業注冊-小編為您整理的
【行政法規】
中華人民共和國國務院《醫療器械監督管理條例》(中華人民共和國國務院令 第739號(2020年12月21日國務院第119次常務會議修訂通過,自2021年6月1日起施行。))第二十一條 從事第一類醫療器械生產的,由生產企業向所在地設區的市級人民政府食品藥品監督管理部門備案并提交其符合本條例第二十條規定條件的證明資料。
【部門規章】
國家市場監督管理總局《醫療器械生產監督管理辦法》(國家市場監督管理總局令第28號) 第十條 在境內從事第二類、第三類醫療器械生產的,應當向所在地省、自治區、直轄市藥品監督管理部門申請生產許可,并提交下列材料: (一)所生產的醫療器械注冊證以及產品技術要求復印件; (二)法定代表人(企業負責人)身份證明復印件; (三)生產、質量和技術負責人的身份、學歷、職稱相關材料復印件; (四)生產管理、質量檢驗崗位從業人員學歷、職稱一覽表; (五)生產場地的相關文件復印件,有特殊生產環境要求的,還應當提交設施、環境的相關文件復印件; (六)主要生產設備和檢驗設備目錄; (七)質量手冊和程序文件目錄; (八)生產工藝流程圖; (九)證明售后服務能力的相關材料; (十)經辦人的授權文件。 申請人應當確保所提交的材料合法、真實、準確、完整和可追溯。 相關材料可以通過聯網核查的,無需申請人提供。 第二十二條 從事第一類醫療器械生產的,應當向所在地設區的市級負責藥品監督管理的部門備案,在提交本辦法第十條規定的相關材料后,即完成生產備案,獲取備案編號。醫療器械備案人自行生產第一類醫療器械的,可以在辦理產品備案時一并辦理生產備案。 藥品監督管理部門應當在生產備案之日起3個月內,對提交的資料以及執行醫療器械生產質量管理規范情況開展現場檢查。對不符合醫療器械生產質量管理規范要求的,依法處理并責令限期改正;不能保證產品安全、有效的,取消備案并向社會公告。 第二十三條 第一類醫療器械生產備案內容發生變化的,應當在10個工作日內向原備案部門提交本辦法第十條規定的與變化有關的材料,藥品監督管理部門必要時可以依照本辦法第二十二條的規定開展現場核查。
拓展閱讀:海南第一類醫療器械生產備案
 海南稅務登記查詢常見問題解答 2024-01-08
海南稅務登記查詢常見問題解答 2024-01-08 2024年普通落戶海南需要什么材料?是否可以直接參加海南高考? 2024-03-10
2024年普通落戶海南需要什么材料?是否可以直接參加海南高考? 2024-03-10 外媒關注海南免簽放寬:謀求變為重要自由貿易港 2024-02-28
外媒關注海南免簽放寬:謀求變為重要自由貿易港 2024-02-28 20%!海南下調首套住房公積金貸款最低首付比例 2024-02-28
20%!海南下調首套住房公積金貸款最低首付比例 2024-02-28 什么叫海南封關?海南封關后海南戶口有什么好處?一文了解! 2024-02-28
什么叫海南封關?海南封關后海南戶口有什么好處?一文了解! 2024-02-28 市場監管總局:過渡期內減資有便利安排! 2024-02-28
市場監管總局:過渡期內減資有便利安排! 2024-02-28- 藥品經營許可證辦理需要什么材料
- 藥品經營許可證辦理需要什么材料呢
- 更多...









